Wasserhärte
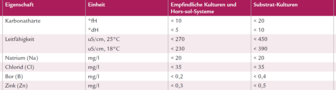
Bei der Wasserhärte wird unterschieden zwischen der Gesamthärte (sie umfasst die Summe der im Wasser gelösten Erdalkalien, das sind im wesentlichen Calcium und Magnesium) und der Karbonathärte, auch temporäre Härte genannt. Für die Beurteilung der Wasserqualität ist die Karbonathärte entscheidend, denn sie beeinflusst den pH-Wert des Wassers. Wie der Name andeutet, bezeichnet die Karbonathärte jene Menge Erdalkali die als Hydrogenkarbonat im Wasser gelöst sind und beim Kochen oder Eintrocknen zu Karbonatablagerungen führen (üblicherweise als Kalk bezeichnet).
Entscheidend für die Beurteilung der Giesswasserqualität ist jener Anteil an Calcium (und Magnesium), der als sogenanntes Hydrogenkarbonat vorliegt (HCO-3). Dieser Anteil wird als Karbonathärte bezeichnet.
- Hydrogenkarbonat wirkt sich im Wurzelraum und in Bewässerungssystemen negativ aus:
- Es erschwert die Eisenaufnahme.
- Es erhöht den pH-Wert des Bodens/Substrates.
- Es führt zu Kalkablagerungen im Bewässerungssystem (Leitungen, Tropfer).
- Es hat eine pH-erhöhende Wirkung und kann so den pH-Wert in einem Substrat anheben. Dieser Effekt ist besonders bei säureliebenden Pflanzen unerwünscht. In Substraten mit schwacher Pufferung können jedoch auch andere Kulturen negativ auf den erhöhten pH-Wert reagieren. Lediglich in Fällen, wo eine pH-Erhöhung notwendig ist, bringt eine gewisse Karbonathärte Vorteile.
Regenwasser weist keine Karbonathärte auf und ist somit das ideale Giesswasser. Weder Calciumhydrogenkarbonat noch Magnesiumhydrogenkarbonat liegen als solche im Wasser gelöst vor. Allerdings muss man dann beachten, dass u.U. die Nährstoffe Calcium und Magnesium fehlen. Des Weiteren ist Regenwasser nicht gepuffert und reagiert stark auf pH-beeinflussende Vorgänge wie die physiologische pH-Senkung durch Ammonium.
Französische und deutsche Härtegrade
Die Wasserhärte wird in französischen (°fH) oder in deutschen Härtegraden (°dH) angegeben. Die Masseinheiten haben sich aufgrund der angewendeten Analyseverfahren als Bezugsgrössen (Fällung oder Titration) ergeben.
Umrechnung: 1 °fH = 0,56 °dH und 1 °dH = 1,78 °fH
So wird die Wasserhärte ermittelt
Im Prinzip kann jede wasserlösliche Calciumverbindung (allgemein Erdalkalien) einen Beitrag zur Gesamtwasserhärte liefern. Dies können Hydrogenkarbonate, Sulfate, Nitrate sowie auch Chloride und andere mehr sein. Zur Bestimmung der Wasserhärte misst man aber das gelöste Calcium (andere Erdalkali können vernachlässigt werden) und rechnet es gemäss Formel in die entsprechenden Härtegrade um. Der so ermittelte Wert wird als Gesamthärte bezeichnet.
Beispiel zur Berechnung der Gesamthärte
Messung: 80 mg Ca/1
In °fH: 80 mg/1: 4 mg/I pro °fH = 20 °fH
In °dH: 80 mgll: 7,14 mg/1 pro °dH = 11,2 °dH
Wie wichtig ist der pH-Wert des Giesswassers?
Der pH-Wert des Giesswassers wird im Wesentlichen durch die gelöste Kohlensäure bestimmt. Er ist für die Beurteilung der Giesswasserqualität nicht geeignet. Werte über 7 bedeuten nicht, dass das Wasser hart ist. Häufig weist weiches Wasser relativ hohe pH-Werte auf (Baseneinfluss von Zement oder Gestein bei fehlender Pufferung).
Die Bedeutung des Salzgehalts (Leitfähigkeit)
Der Salzgehalt bezieht sich auf die Ionenkonzentration im Giesswasser. Er wird als Leitfähigkeit gemessen. Diese gibt Auskunft über den Gesamt-Salzgehalt, jedoch nicht über die Zusammensetzung der Ionen.
Weil Trinkwasser in Mitteleuropa ausser Hydrogenkarbonat meist nur wenig andere Salze enthält, ist der Zusammenhang zwischen der Karbonathärte und der Leitfähigkeit eng. Ist die Karbonathärte bekannt und die gemessene Leitfähigkeit deutlich höher als erwartet, liegen nebst den „Härteionen“ noch andere Salze vor. In diesem Fall sollte eine Wasseranalyse durchgeführt werden.